器官需要持续不断的血液、营养和氧气供应才能正常工作。
两个独立的研究团队发现了一种在实验室培育的器官内生长血管的方法。
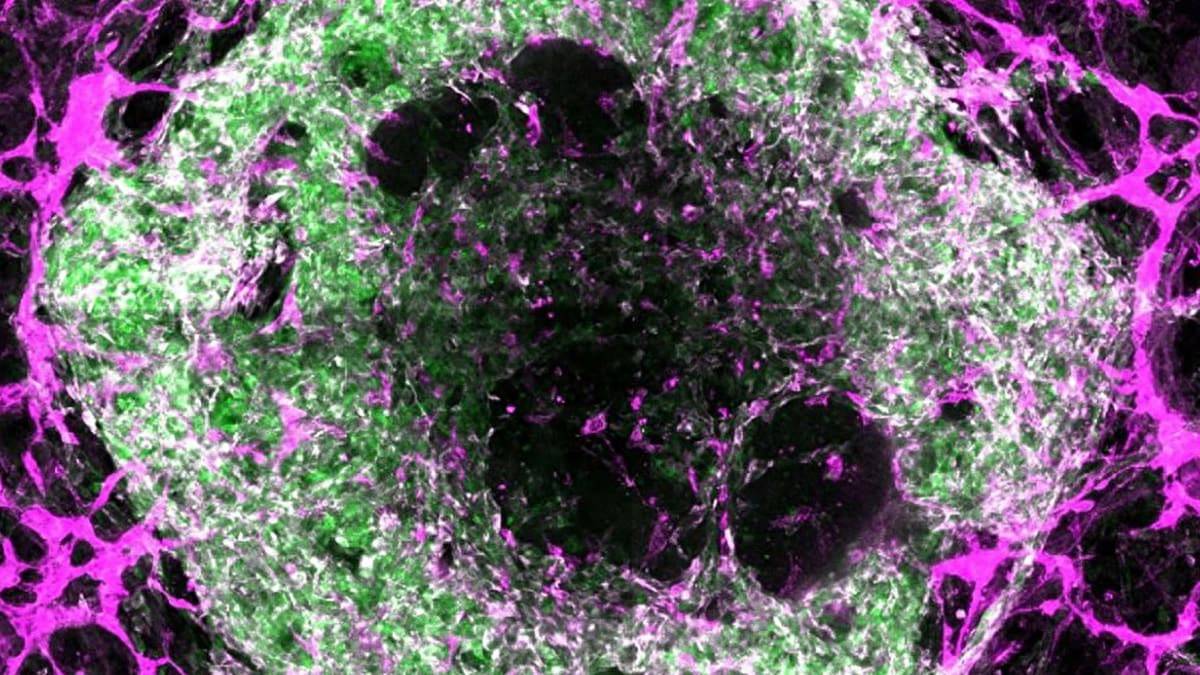
在实验室制造微型器官,如心脏、肝脏和肺的微小复制品,一直是科学家们关注的重点。这些被称为“类器官”的结构,极大地推进了我们研究疾病和测试新药的方式。
但其中始终缺少关键一环:血管。器官需要持续不断的血液、营养和氧气供应才能正常工作。没有这些血管网络,实验室培育的类器官就无法长到足够大的尺寸、无法完全发挥功能或完全成熟。例如,没有必要的血管系统,微型肾脏就无法有效过滤血液,微型肺也无法进行气体交换。
就在刚过去的这个月,发表在《科学》和《细胞》杂志上的两项新研究宣布了一种解决这一挑战的突破性新方法。《自然》杂志报道称,这种方法可以让研究人员在培育器官组织的同时,从一开始的发育阶段就同步培育血管,而不是试图在后期阶段再将血管整合进去。
功能性肺类器官
这一切始于多能『干细胞』 —— 人体的万能细胞,能够转化为几乎任何类型的细胞。研究人员现在正引导这些神奇的细胞同时形成器官组织和血管。
为了解决实验室培育器官缺乏血管的问题,加州大学的团队首先尝试分别组装各个组件。他们使用荧光标记来区分细胞类型,期望红色代表血管,绿色代表肺组织,然后再将它们组合起来。
然而,他们惊讶地发现,红色的血管网络和红色的上皮细胞(肺组织)竟然从相同的起始材料中同时发育出来。据报道,这些通常被视为“污染物”,但研究人员探索了如何放大这一过程。
他们开发了一种新策略,让肺组织和血管从一开始就共同生长,从而更接近地模拟自然肺部的发育过程。与之前的模型相比,这种方法产生的微型器官具有更大的细胞多样性、更好的三维结构、更高的细胞存活率以及更成熟的发育。
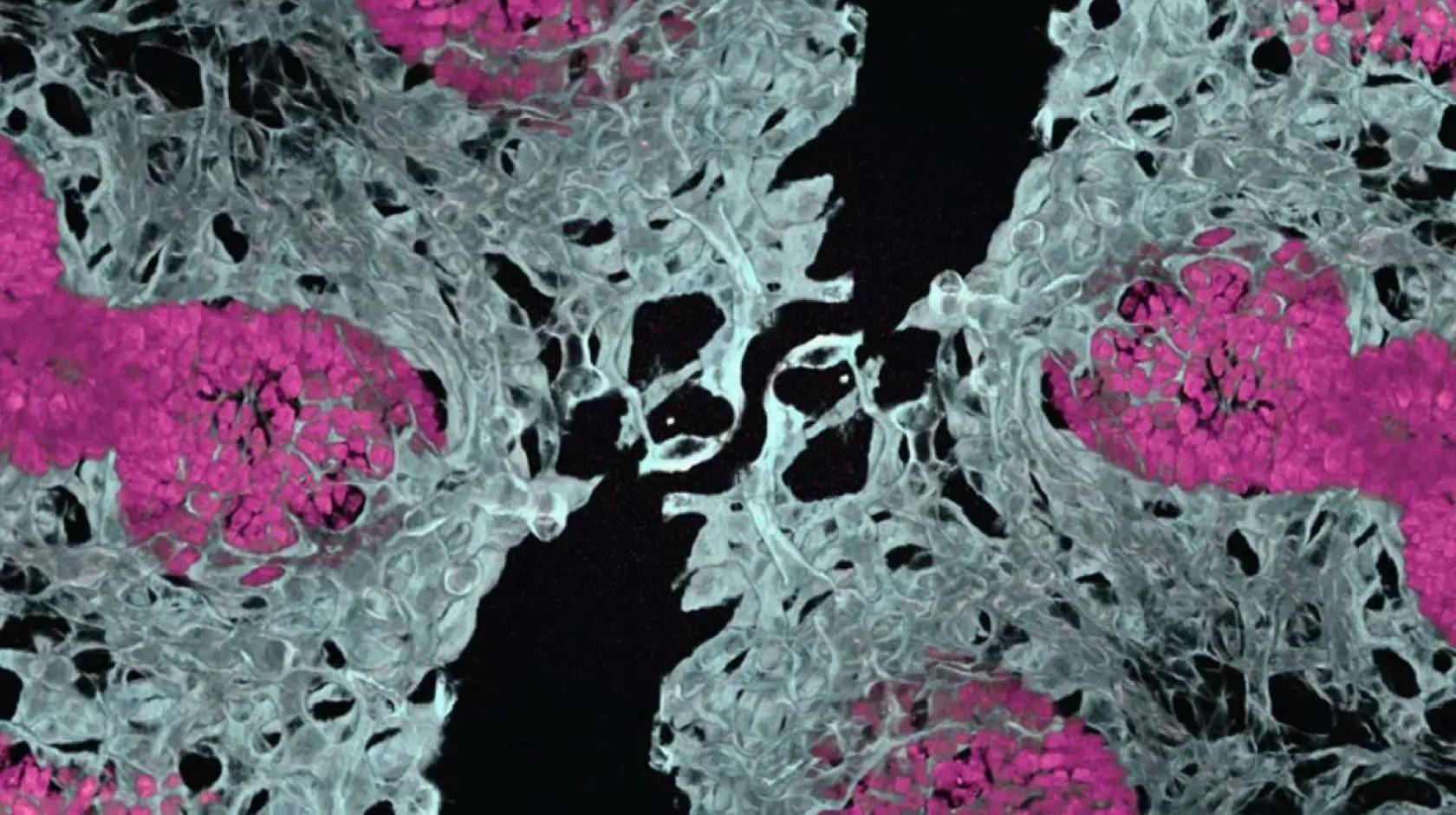
当移植到小鼠体内后,这些新型肺类器官成熟并形成了多种细胞类型,甚至创造了对于气体交换至关重要的肺泡囊。
研究团队立即将改进的微型肺模型投入实际应用。他们开始研究一种名为《肺泡毛细血管发育不良伴肺静脉错位》(Alveolar Capillary Dysplasia with Misalignment of Pulmonary Veins, ACDMPV)的罕见且通常致命的肺部疾病,该病影响新生儿,由FOXF1基因突变引起。
多样化的心脏细胞
与此同时,在奥斯卡·阿比莱兹(Oscar Abilez)博士领导的斯坦福医学院,研究人员也取得了重大成功。
他们专注于培育带有自身微小功能性血管的心脏和肝脏类器官。
阿比莱兹团队的目标是优化一种化学“配方”,以可靠地生成人类心脏中几乎所有细胞类型,包括血管网络。他们结合了制造心肌细胞、内皮细胞和平滑肌细胞的成熟方法,测试了34种不同的生长因子和其他分子的组合。
在生长两周后,其中一种名为“条件32”(condition 32)的配方被证明特别有效。它产生了色彩丰富的心脏类器官,表明其中含有大量的心肌细胞、内皮细胞和平滑肌细胞。
在3D显微镜🔬下,这些成功的环形类器官显示出有序的结构:心肌细胞和平滑肌细胞位于内部,外层被内皮细胞包裹,内皮细胞形成了清晰可见、类似毛细血管的分支血管网络。
更令人惊讶的是,对这些类器官进行的单细胞RNA测序(scRNA-seq)分析发现了人类心脏中几乎所有其他类型的细胞。
“它包含了心脏中发现的所有这些其他细胞类型,”阿比莱兹说,“这出乎意料,但令人惊喜。”
这些关于培育带血管类器官的研究,代表了在人类发育和疾病研究领域向前迈出的重要一步。
如果朋友们喜欢,敬请关注“知新了了”!




