今天分享的是:药品和医疗器械警戒领域的前瞻性监管情报
报告共计:27页
药品和医疗器械警戒领域监管情报核心总结
本白皮书基于科睿唯安对过去五年50个国家/地区卫生部门发布的1328份相关监管文件的分析,聚焦药物警戒和医疗器械警戒领域的监管格局与发展趋势,为行业提供前瞻性情报参考。
药物警戒和医疗器械警戒是产品生命周期监管的核心支柱,虽均以保障公众健康为目标,但监管要求存在显著差异。药物警戒覆盖药品全生命周期的不良反应监测与风险预防,上市前依赖严格的临床试验安全性报告,上市后需开展信号检测、个例安全性报告等持续监测。医疗器械警戒则侧重设备相关伤害事件监测,上市前要求因风险等级而异,上市后以事件报告和纠正措施为主,且标准化程度仍在逐步提升。
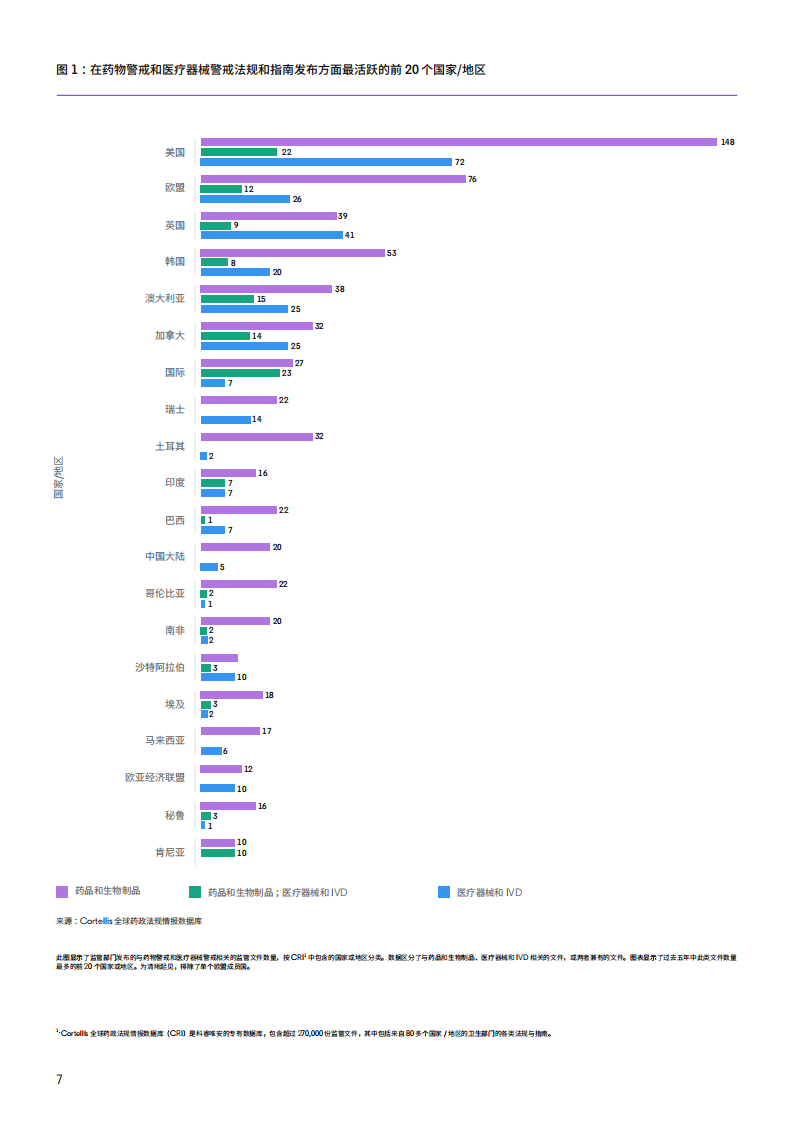
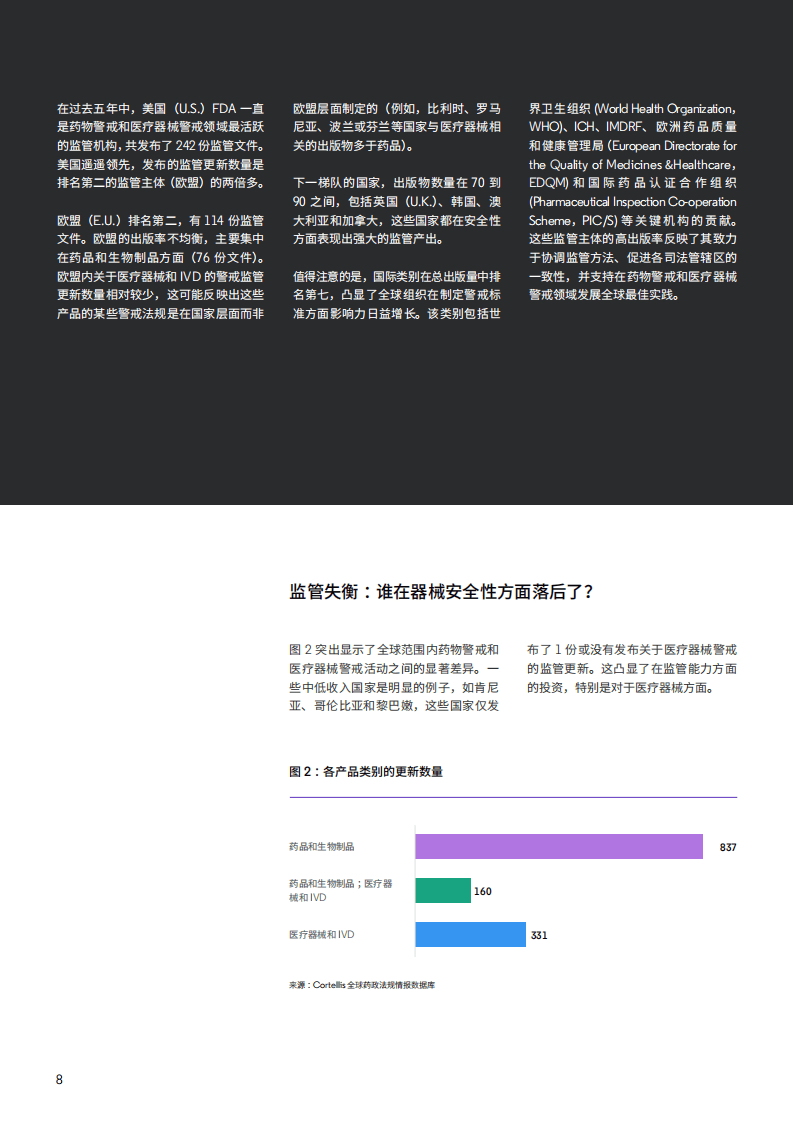
全球监管格局呈现明显的地域差异。美国以242份监管文件位居榜首,欧盟紧随其后发布114份文件,英国、韩国等国家也保持高频监管产出。而摩洛哥、越南等部分国家相关监管文件不足2份,监管参与度较低。在产品类别上,多数国家更侧重药物警戒监管,英国、沙特阿拉伯等少数国家实现了两类产品警戒监管的均衡发展,部分中低收入国家则在医疗器械警戒领域存在明显滞后。
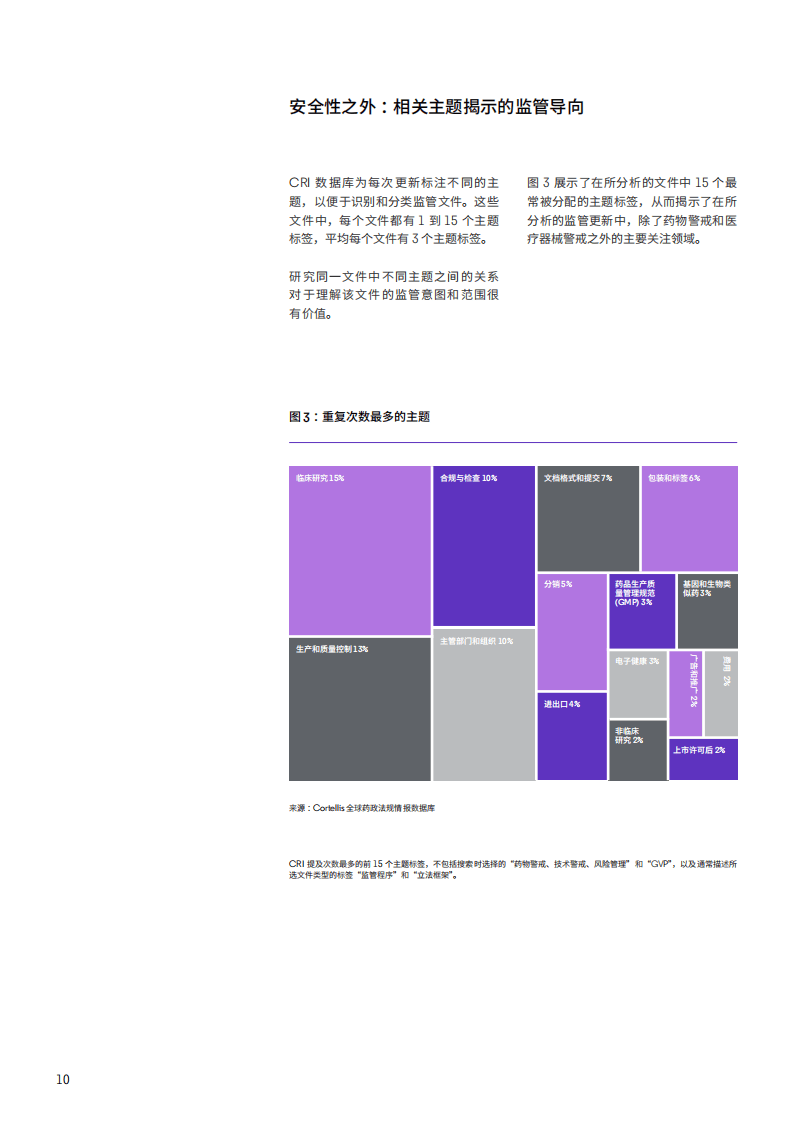
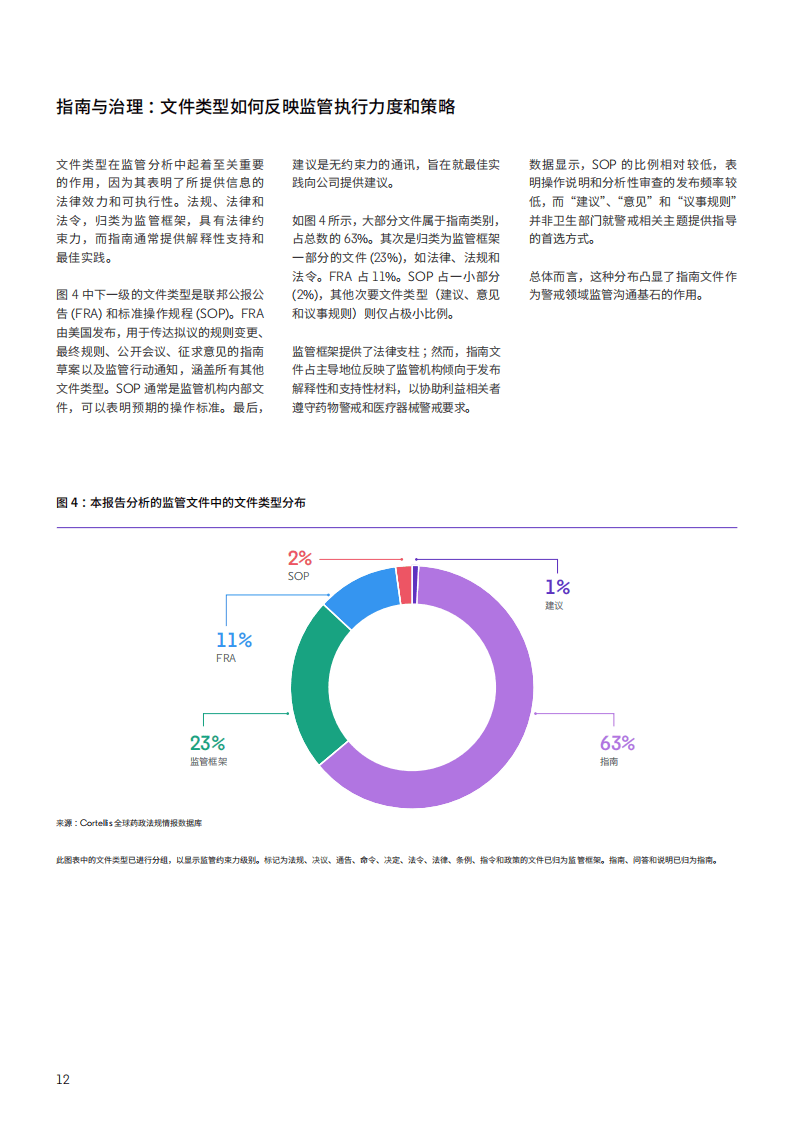
监管文件的主题与类型也呈现鲜明特征。主题方面,临床研究、生产和质量控制、合规与检查是重点关注领域,电子健康作为新兴主题,其在数据收集、信号检测及监管沟通中的作用日益凸显。文件类型上,指南类文件占比63%,成为监管沟通的主要形式,法律、法规等具有约束力的监管框架文件占23%,为合规提供法律基础。
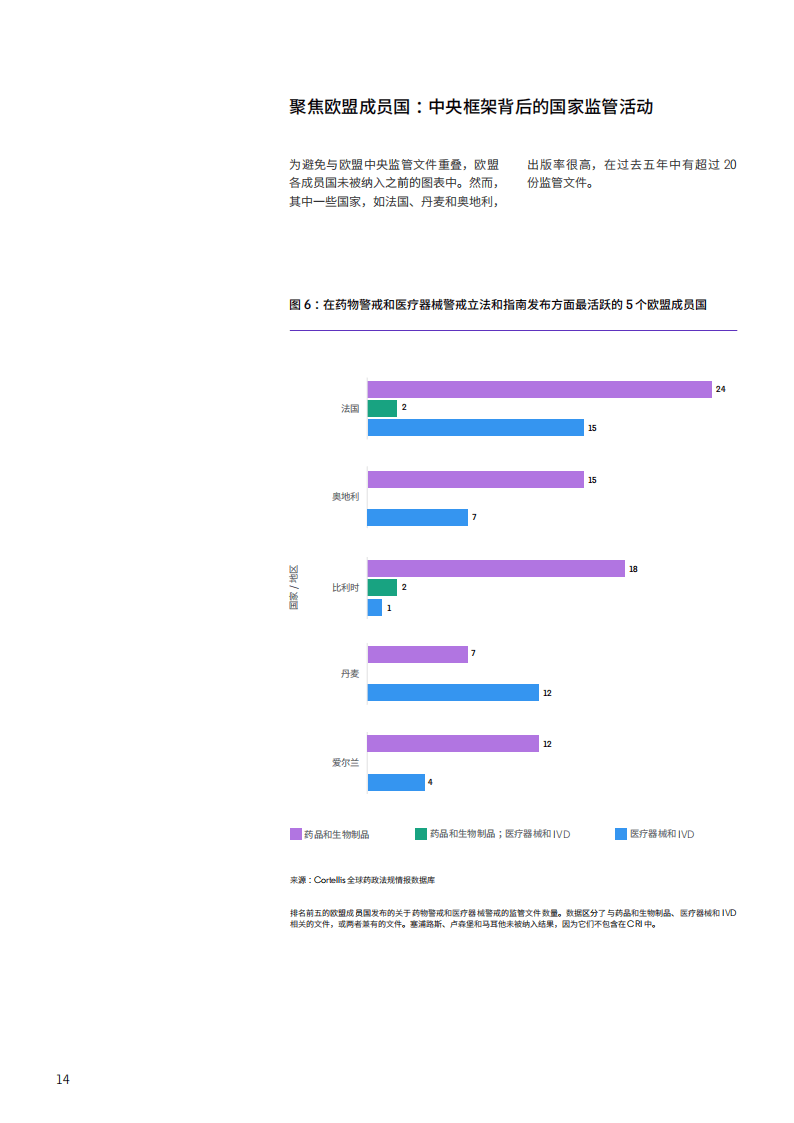
国际组织在监管协调中发挥关键作用,WHO、ICH、IMDRF等机构通过制定标准和指南,推动全球警戒监管的一致性。欧盟层面,法国在成员国中监管活动最为活跃,比利时等国则重点推进医疗器械警戒相关法规实施,体现了欧盟框架下的国家差异化执行特点。
总体而言,全球药品和医疗器械警戒监管正持续演变,监管范围不断扩大、协调力度逐步增强,数字技术与警戒系统的融合成为重要趋势。对于制药和医疗器械组织而言,主动追踪监管动态、适配监管要求,既是合规保障,也是提升运营效率、保障产品市场准入的关键,更能为全球患者安全提供有力支持。
以下为报告节选内容